 Graduado em Farmácia-Bioquímica pela Faculdade de Ciências Farmacêuticas da Universidade de São Paulo (USP), com doutorado pelo Instituto de Química da USP – para o qual contou com Bolsa da FAPESP –, o pesquisador está desde 2007 em San Diego.
Graduado em Farmácia-Bioquímica pela Faculdade de Ciências Farmacêuticas da Universidade de São Paulo (USP), com doutorado pelo Instituto de Química da USP – para o qual contou com Bolsa da FAPESP –, o pesquisador está desde 2007 em San Diego.Antes de embarcar para o hemisfério norte, Corrêa lecionou na USP. A iniciativa de se mudar para os Estados Unidos surgiu após o convite do Sanford-Burnham para desenvolver pesquisas com fármacos.
Muitas células, velhas ou doentes, do corpo humano passam pela morte celular programada, um processo peculiar de eliminação que é também considerado importante na modulação da progressão do câncer.
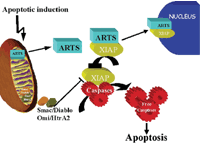
Nesse processo, a ARTS é ligada à XIAP, responsável por regular a ação de caspases (enzimas inibidoras da apoptose) por meio do fluido intracelular. A morte da célula ocorre quando a ARTS é liberada.
Tal atividade, até então pouco conhecida, necessita de um estímulo para ocorrer. O trabalho de Corrêa e colegas desvenda como a proteína XIAP é sequestrada e inibida por ARTS.
No estudo, o grupo descreve o papel de uma terceira proteína, Siah, na atividade pró-apoptótica da proteína ARTS liberada. Nesse processo, o novo componente participa por meio da ubiquitinação, processo em que as células indesejadas são marcadas com uma proteína chamada ubiquitina para que possam ser degradadas pelas organelas proteossomas.
A ARTS atua como um sinalizador para atrair o ataque de Siah à XIAP e essa atividade ocasiona a morte da célula. Em alguns casos de câncer infantil, como leucemia linfoblástica aguda ou leucemia melogênica aguda, há uma perda superior a 70% da proteína encontrada na mitocôndria, o que evidencia o papel de ARTS como inibidor do processo de oncogênese.
Processo inverso
Corrêa destaca também o efeito contrário à morte celular que a mesma proteína pode vir a ter. “O próximo passo da pesquisa é o desenvolvimento de terapias citoprotetoras e peptídeos que tenham funções análogas à ARTS”, disse.
“O efeito contrário, no qual temos a elevação de XIAP, também é interessante. Não do ponto de vista oncológico, mas, por exemplo, na preservação de neurônios”, indicou.
Nesse caso, o grupo pretende desenvolver peptídeos capazes de sequestrar a proteína Siah do processo para que seja possível inibir a apoptose, criando, com isso, um efeito protetor da célula.
A ideia é obter peptídeos em porções similares à ARTS para que possam corromper as ligações das moléculas de Siah. Com isso, a atividade de XIAP é afetada, o que pode evitar a morte celular.
Doenças do sistema nervoso responsáveis pela degradação das células neurais, como Parkinson, Huntington, Alzheimer e esclerose múltipla podem ser beneficiadas com o estudo. Outro dado importante para o desenvolvimento de drogas, tanto para o câncer como para doenças do sistema nervoso, é a localização da molécula.
“De acordo com a região onde a ARTS está ligada a XIAP, podemos desenvolver peptídeos com ações miméticas de ARTS e modular eventos de aumento ou diminuição de XIAP, enfocando um papel oncológico ou de proteção neuronal”, disse Corrêa.
O artigo ARTS and Siah Collaborate in a Pathway for XIAP Degradation (doi: 10.1016/j.molcel.2010.12.002), de Jason B. Garrison e outros, pode ser lido por assinantes da Molecular Cell em www.cell.com/molecular-cell/home.
Agência FAPESP



